人源化小鼠肿瘤模型
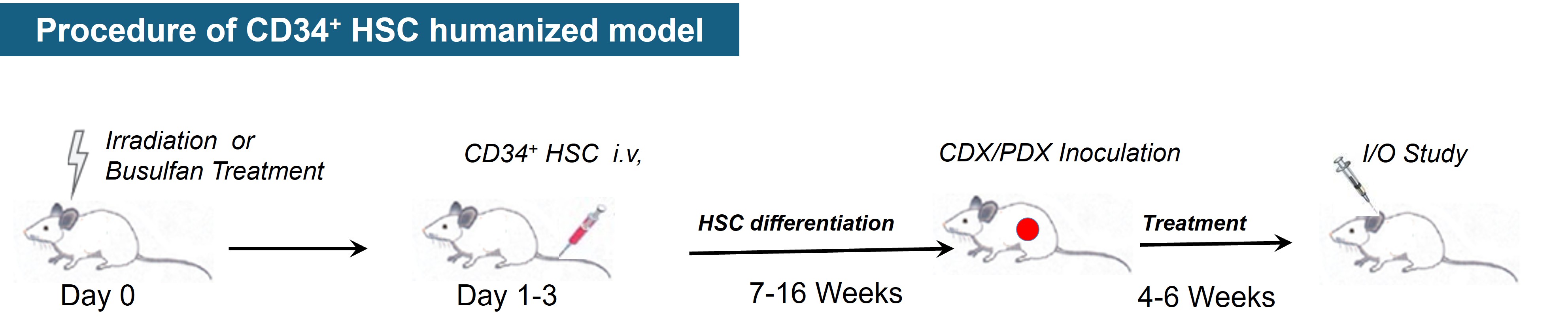
hHSC人源化小鼠肿瘤模型
hHSC(humanized-hematopoietic stem cells)人源化小鼠肿瘤模型是把人CD34+HSCs注射到免疫缺陷宿主小鼠中,该方法需要首先对宿主小鼠进行亚致死剂量的辐照以消除小鼠HSC并促进人HSC的移植。hHSC是人体造血组织中能自我更新, 又能分化产生各系血细胞的一类细胞。CD34抗原是人们普遍认同的造血干/祖细胞的代表性表面标志, 它是一个高度糖基化的I型跨膜糖蛋白, 具有调节细胞粘附性的作用, 能促进细胞对骨髓基质的粘附。通过静脉内(i.v.)或股骨内(i.f.)将来自人脐带血、骨髓、G-CSF激活的外周血或胎肝的人CD34+HSCs注射到成年免疫缺陷小鼠中,可以产生多种造血干细胞,但T细胞产生量少,不具备功能性免疫细胞。或通过静脉注射(心内或肝内)将人CD34+HSCs移植到新生受体小鼠中(小于4周龄),得到良好的人细胞移植,并且产生T细胞、B细胞、巨噬细胞、NK细胞和DC细胞。
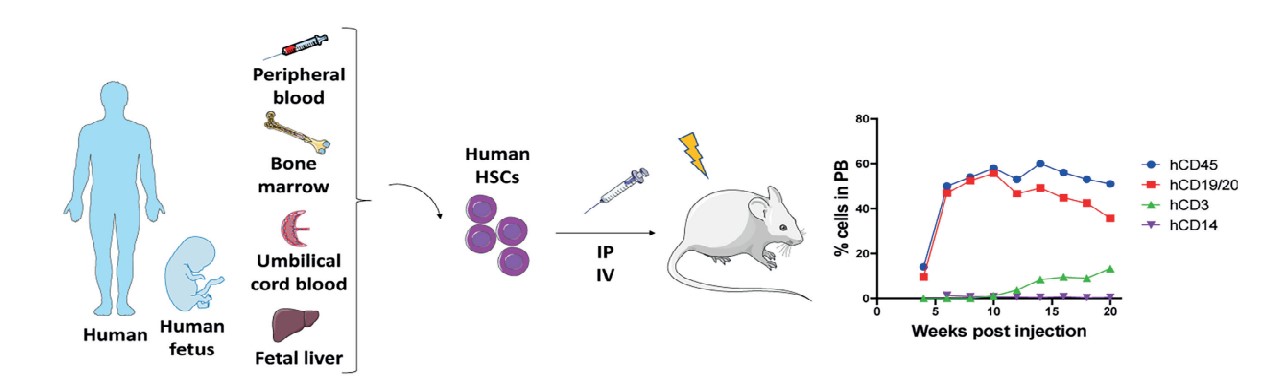
Cogels M, et al. Front Oncol. 2021, 11:784947.
hHSC人源化小鼠模型药物评价
hPBMC人源化小鼠肿瘤模型
人外周血单个核细胞(humanized-peripheral blood mononuclear cells,hPBMC)人源化小鼠肿瘤模型是将纯化的人类PBMCs静脉注射到重度免疫缺陷小鼠中,人类免疫系统在小鼠外周血和淋巴组织中部分重建,注射到小鼠体内的hPBMC数量一般在5-10x106之间,在hPBMC注射后3-4周,小鼠外周血中可以检测到高水平的人类免疫细胞,主要是hCD45+CD3+T细胞,而人类B细胞和髓系细胞水平较低。虽然移植的hCD45+CD3+T细胞最终会与小鼠主要组织相容性复合物(MHC)I类和II类分子反应,诱导移植物抗宿主病(GvHD),导致小鼠在成功免疫重建后6-8周内死亡。但是由于该模型具有制备简便,周期短,小鼠外周血中hCD45+CD3+T细胞水平高,以及可以移植来自同一患者的hPBMCs和肿瘤组织等优势。hPBMCs模型受到追捧并被广泛使用。
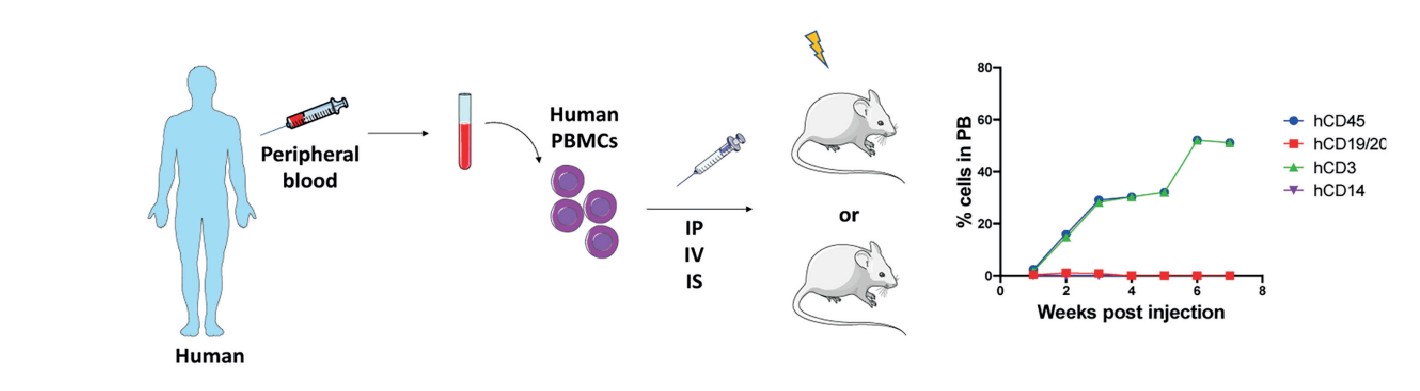
Cogels M, et al. Front Oncol. 2021, 11:784947.
hPBMC人源化小鼠肿瘤模型药效评价
hNK细胞人源化小鼠肿瘤模型
自然杀伤(natural killer,NK)细胞约占总淋巴细胞的5-20%,可以对病毒或恶性细胞做出特定反应,当检测到病毒感染或肿瘤细胞时,它们锁定目标并通过诱导细胞凋亡来破坏它们,同时通过释放炎症细胞因子发出危险信号,所以在癌细胞的清除和癌症治疗中,NK细胞发挥着重要作用。NK细胞不需要先激活就能够直接杀死病毒感染的细胞和肿瘤细胞,不仅在肿瘤发生的早期阶段迅速识别并发挥对靶细胞的直接杀伤,还可以与包括DC细胞在内的免疫细胞进行联系,以改变适应性免疫应答,从而增强CD8+T细胞介导的抗肿瘤应答。在多种肿瘤环境中,CD8+T细胞的抗肿瘤能力需要NK细胞功能,NK细胞在其表面上表达多种激活受体,抑制受体和细胞因子或趋化因子受体,其激活和功能依赖于来自抑制受体的信号传导和激活受体之间的平衡。目前常用的使用免疫系统人源化动物模型得到植入人免疫系统的小鼠,接种肿瘤细胞后进行给药治疗,精诚智研开发了这种动物模型,可以满足NK细胞相关治疗药物开发的各种需求。
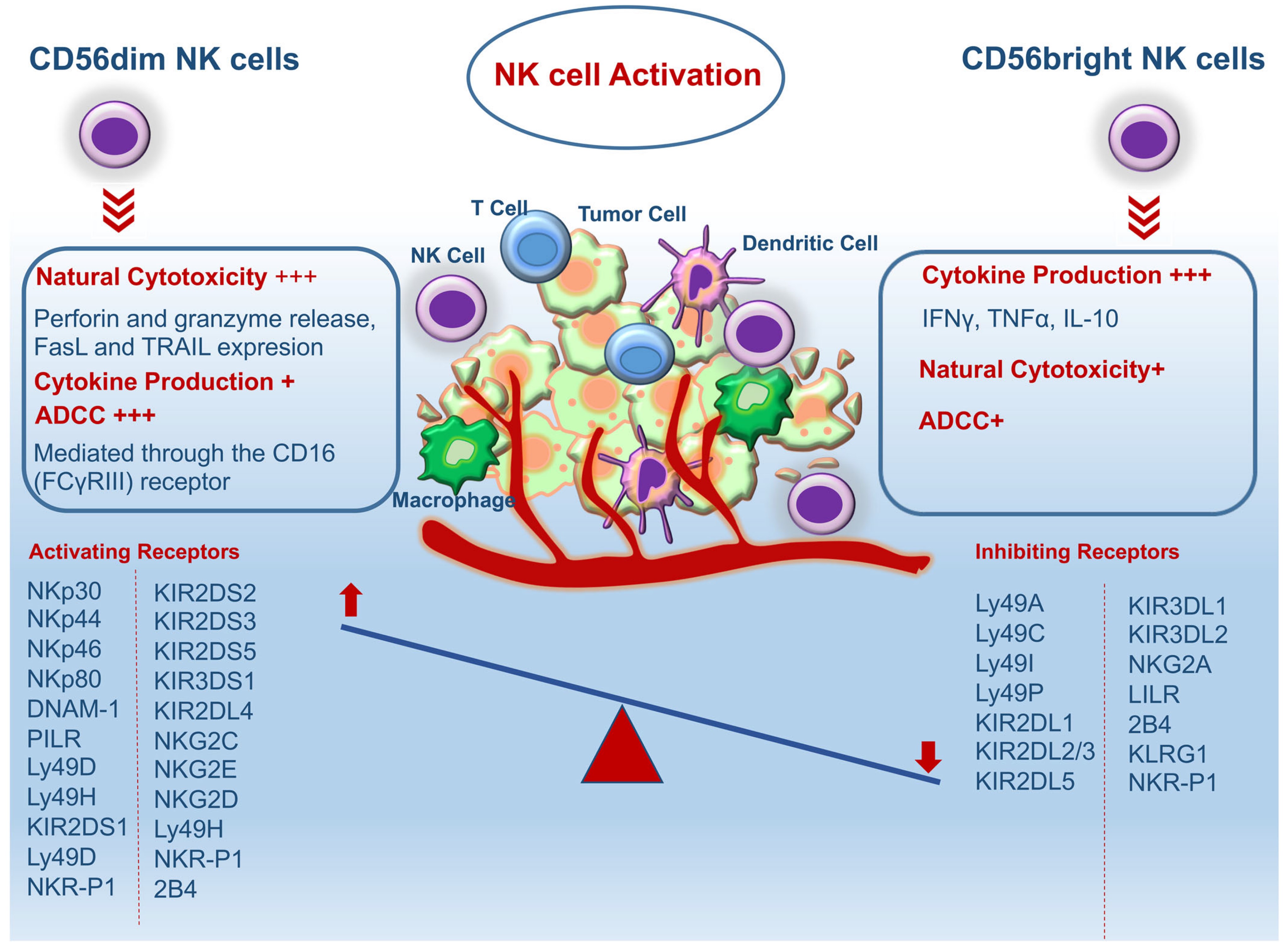
Schematic diagram of types and functions of NK cells for killing tumors.
Ghaedrahmati F, et al. Cancer Commun (Lond). 2023; 43(2):177-213.
hM髓系免疫细胞人源化小鼠肿瘤模型
精诚智研成功开发了髓系免疫细胞人源化肿瘤模型,为客户提供更多针对hM髓系细胞治疗药物开发提供技术服务。髓系细胞是肿瘤微环境中重要的免疫细胞,在肿瘤微环境中既可以发挥免疫抑制也可以发挥免疫刺激作用。髓系细胞包括许多不同的细胞类型,包括单核细胞、巨噬细胞、DC,这些细胞具有高度可塑性,并可以根据微环境的特征而分化为不同的表型。针对髓系免疫细胞人源化重建肿瘤模型的开发,有助于相应靶点的挖掘及药物治疗策略的开发。
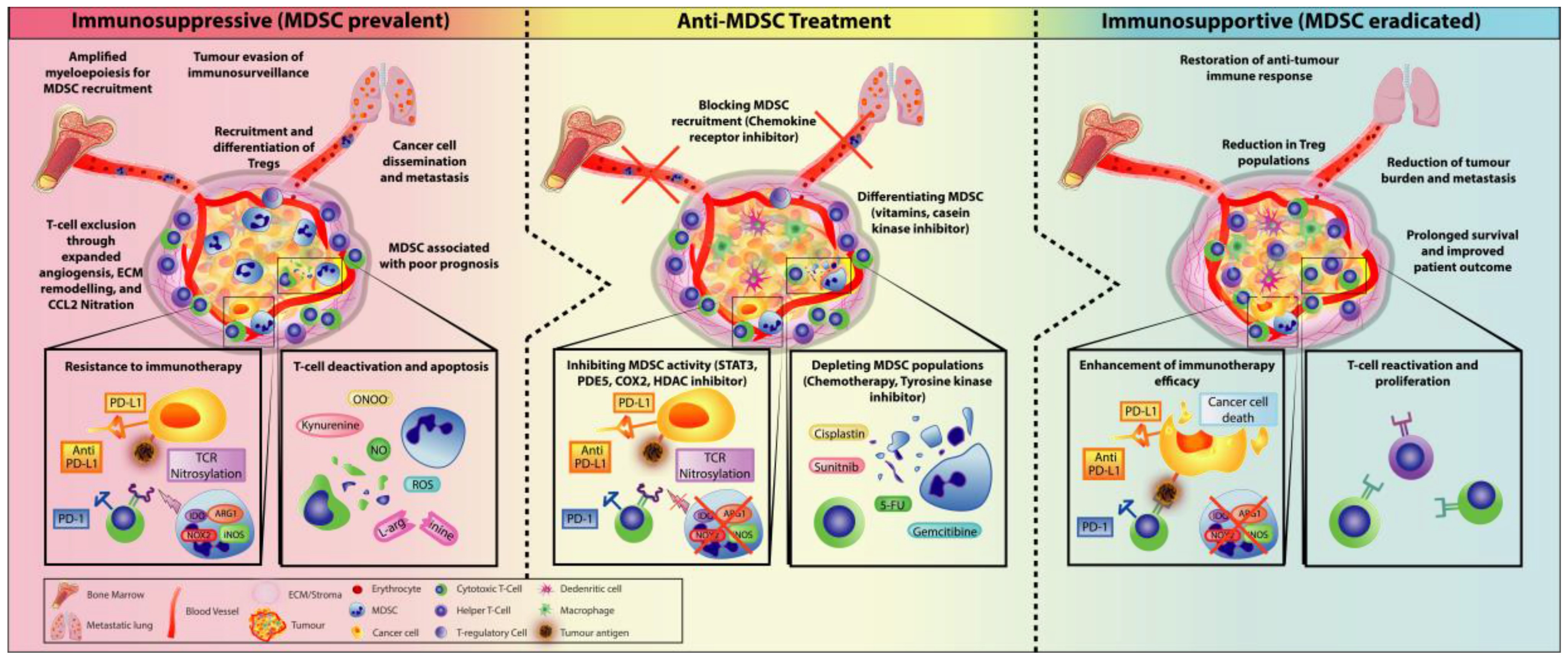
Law A, et al., Cells. 2020; 9(3):561.