精诚智言:屋尘螨诱导过敏性哮喘模型
近年来,呼吸道过敏性疾病在全球范围内的患病率呈上升趋势。过敏性哮喘(Allergic asthma,AA)是呼吸道过敏性疾病的重要组成部分,是儿童时期最常见的呼吸系统疾病,占支气管哮喘成人患者人数的50%。全球约有10%的儿童患有AA的风险。患者临床典型症状表现为喘息、夜间咳嗽、胸闷及呼吸困难,尤其在湿度高的夏秋季或夜间加重。其病理特征主要表现为呼吸道高反应性(Airway hyperresponsiveness,AHR)和结构重塑。炎症导致呼吸道神经末梢暴露,使其对冷空气、烟雾等非特异性刺激敏感性显著升高。长期炎症可导致呼吸道平滑肌增生、胶原沉积,可能进展为不可逆性气流受限。
AA是一种机体对过敏原产生的,以Th2细胞异常免疫应答为主的呼吸道可逆性气流受限的慢性炎症。特异性变应原激活Th2细胞及其分泌的IL-4、IL-5和IL-13等在维持过敏原特异性IgE水平、嗜酸性粒细胞(Eosinophils,EOS)增多、组织炎症和损伤等方面发挥关键作用,导致严重的临床表现和慢性炎症。而Th1细胞分化不足,进而分泌的IFN-γ和IL-2等因子减少,抑制Th2分化的作用减弱,进而促进T细胞向Th2方向分化,IL-4和IL-5 等Th2型细胞因子分泌增多,进一步加重Th1/Th2细胞失衡,促进疾病进展。Th2细胞分泌的细胞因子IL-4能够驱动B细胞产生尘螨特异性IgE抗体,IL-5可招募EOS至呼吸道,IL-13促进黏液分泌及AHR。此外,特异性IgE与肥大细胞、嗜碱性粒细胞(Basophilic granulocyte,BASO)表面FcεRI受体结合,使机体进入致敏状态。另一方面,Th1型免疫反应减弱也是AA发生的重要因素,适量的Th1细胞相关因子 IFN-γ可以阻止T细胞向 Th2 细胞分化,因此适当提高 Th1 型细胞反应可负向调节AA的进展。
AA的病因和发病机制较为复杂,普遍认为是遗传因素和环境因素复杂的相互作用引起的。吸入性过敏原(例如:尘螨、花粉、真菌、毛发和皮屑等)是引起AA最主要的一类过敏原,其中屋尘螨(House dust mite,HDM)是最主要的吸入性过敏原,其分布广泛,并且难以避免。在针对儿童的过敏原检测中,儿童AA患者的HDM阳性率超过85%。在患有AA的儿童中,疲倦、易激惹和注意力不集中是AA控制不佳的典型症状。
螨虫是一个非常微小的肉眼难辨的微生物,通常分为HDM和粉尘螨(Dermatophagoides farinae,Derf)两类。其本身还有一些分泌物和代谢产物,都具有强烈的致敏作用。HDM经常存在家里床上的被褥、枕头、地毯,包括毛绒玩具。只要是可以藏污尘的地方,它都可以滋生。尘螨是以进食粉末包括人的皮屑、动物的皮屑为生,所以它非常容易寄居在皮肤上引起强烈的致敏。典型过敏体质的孩子对尘螨有高度的过敏,而且尘螨过敏是引起常年的过敏,例如引起常年的过敏性鼻炎和哮喘的发作。目前临床防治AA的措施,除了环境控制(湿度<50%、防螨寝具)以外,还包括药物干预治疗、脱敏治疗以及新兴生物疗法。未来基于免疫调节的患者个体化策略有望实现根治目标(Fig.1)。
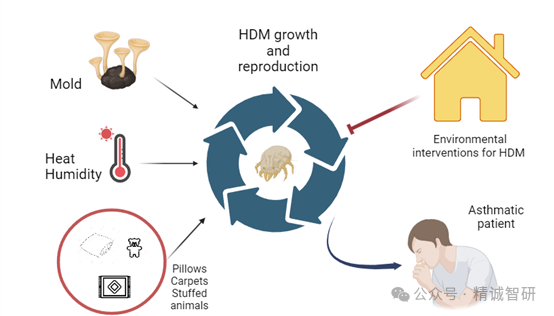
Fig.1:屋尘螨诱导过敏性哮喘的环境因素
研究表明,HDM通过IgE介导的Th2免疫极化诱发呼吸道慢性炎症,其核心机制涉及B淋巴细胞诱导的成熟蛋白1(B lymphocyte-induced maturation protein 1,BLIMP1)依赖的淋巴结T细胞活化、EOS浸润及结构性重塑。HDM排泄物及尸体碎片中含多种致敏蛋白(例如:Der p1和Der p2),通过呼吸道吸入后穿透呼吸道上皮屏障,被树突状细胞(Dendritic cells,DCs)等抗原呈递细胞捕获。DCs迁移至淋巴结,激活初始T细胞分化为Th2细胞,依赖BLIMP1蛋白通路及IL-2和IL-10信号。研究发现IL-10在此阶段表现为促炎作用而非抑炎。尘螨过敏原与致敏细胞表面IgE交联,触发肥大细胞脱颗粒,释放组胺(Histamine)、白三烯(Leukotrienes)和前列腺素(Prostaglandin)等过敏性因子。慢性呼吸道炎症表现EOS浸润,释放EOS阳离子蛋白(Eosinophil cationic protein,ECP)、主要碱性蛋白(Major basic protein,MBP),损伤呼吸道上皮。另外,持续的Th2细胞活化可形成炎症正反馈循环,导致基底膜增厚、杯状细胞增生和呼吸道重塑(Fig.2)。
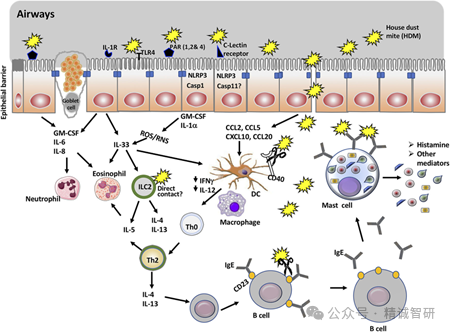
Fig.2:屋尘螨诱导过敏性哮喘的机制
截止目前,AA的发病机制尚未完全清楚,具体机制还有待于进一步探索;临床治疗手段相对药效不足,新的治疗手段还需要进行研究开发。那么临床前AA动物模型为针对AA的机制研究和新药物开发提供了很好的技术手段。上海精诚智研生物医药有限公司研发技术团队根据AA的发病机制和临床病理特征,结合市场客户不同项目需求,采用进行不同建模方法成功开发了HDM诱导的小鼠AA模型。实验数据展示如下:
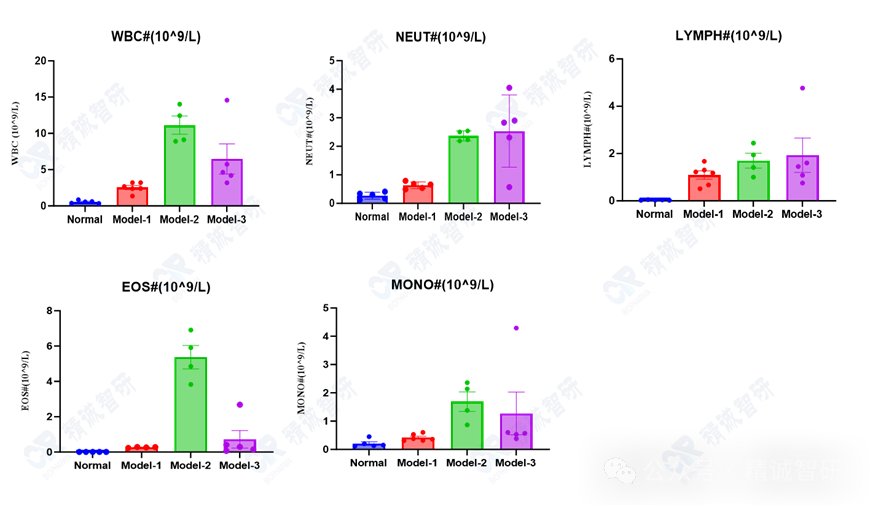
1. CBC检测肺泡灌洗液免疫细胞数量
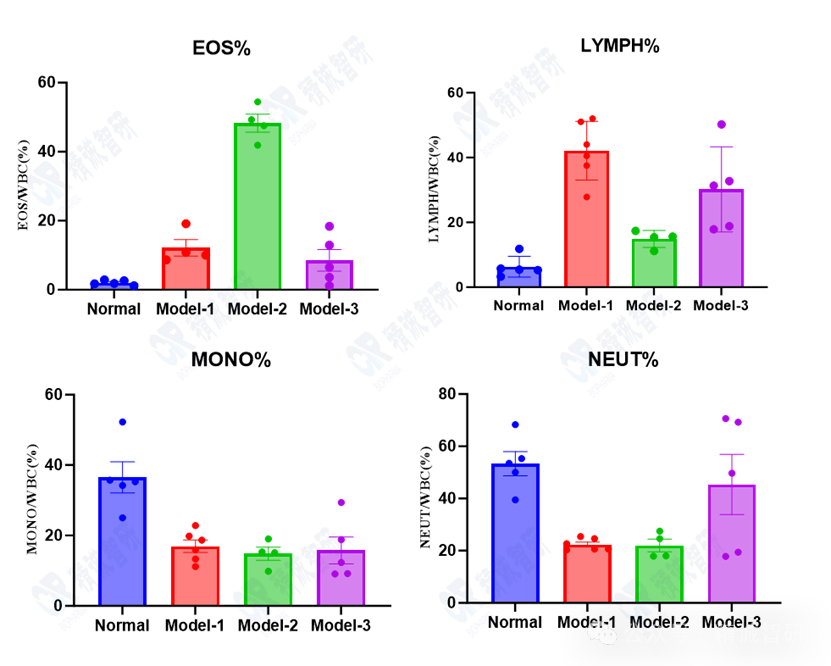
2. CBC检测肺泡灌洗液免疫细胞比例
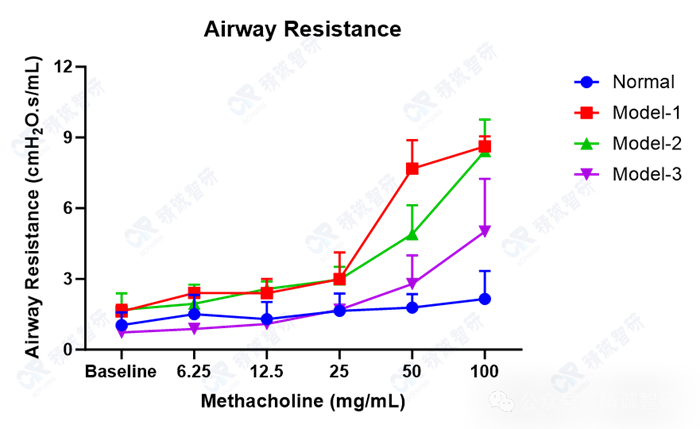
3. 肺功能检测气道阻力
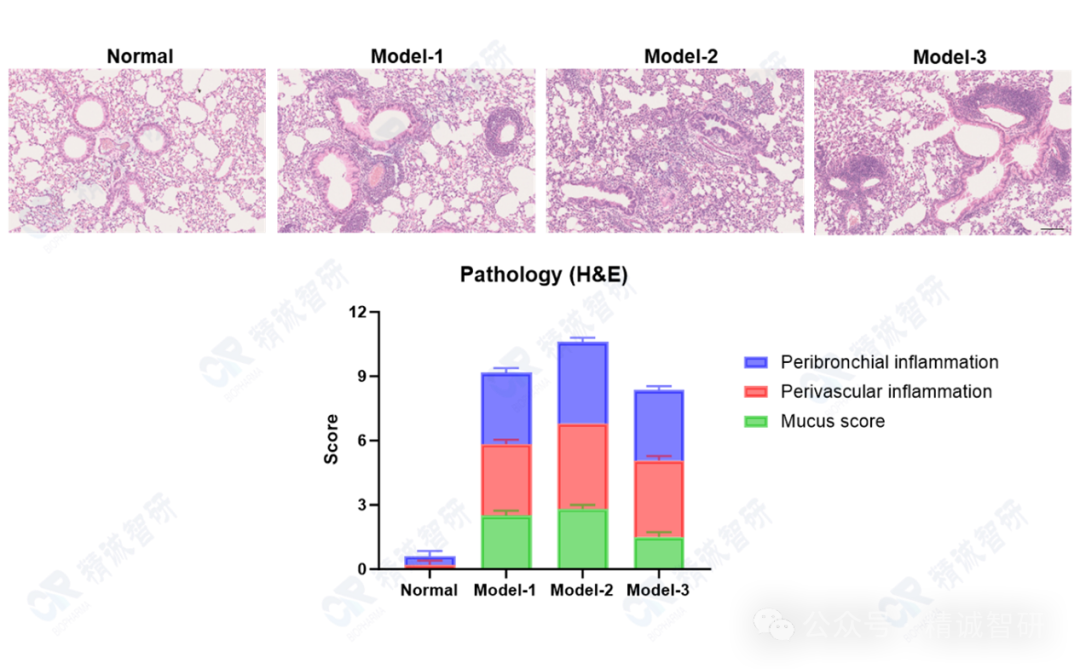
4. HE染色病理学检测结果
参考文献
[1] Klain A, et al. The prevention of house dust mite allergies in pediatric asthma. Children (Basel). 2024; 11(4): 469.
[2] Papadopoulos NG, et al. A current perspective of allergic asthma: from mechanisms to management. Handb Exp Pharmacol. 2022; 268: 69-93.
[3] 付强, 等. 屋尘螨诱导过敏性哮喘伴认知功能障碍小鼠模型的构建. 重庆医科大学学报. 2025; 50(05): 649-656.
[4] Abu Khweek A, et al. Insights into mucosal innate immune responses in house dust mite-mediated allergic asthma. Front Immunol. 2020; 11: 534501.
[5] 马东霞, 等. 胰高血糖素样肽-1调节Th细胞分化对屋尘螨诱导小鼠过敏性气道炎症的影响. 中华临床免疫和变态反应杂志. 2022; 16(03): 246-251.
