Nature综述:CAR-T细胞治疗自身免疫性疾病的进展和挑战
CAR-T细胞疗法已成为复发或难治性B细胞恶性肿瘤患者的标准治疗方法。在过去的几年中,基于CD19和B细胞成熟抗原(BCMA)的CAR-T细胞疗法已被应用于各种B细胞介导的自身免疫性疾病,包括系统性红斑狼疮、特发性炎症性肌病、系统性硬化症、视神经脊髓炎谱系障碍、重症肌无力和多发性硬化症。本篇综述由德国埃尔兰根大学的Georg Schett , Fabian Müller等人发表于Nature Reviews Rheumatology,讨论了CAR- T细胞治疗自身免疫性疾病的重要方面,包括患者选择、安全性、有效性和医疗管理等方向的考虑。
引言
CAR-T细胞是治疗复发或难治性B细胞来源的血液系统恶性肿瘤(如淋巴瘤、白血病和多发性骨髓瘤)的重要工具。作为一类“活的药物”,CAR-T细胞为B细胞源性恶性肿瘤患者提供了新的治疗途径,与检查点抑制剂的发展一起构成了癌症免疫治疗中最重要的突破之一。
对CAR-T细胞在系统性红斑狼疮(SLE)和天疱疮动物模型中的作用的重要认识,为它们在非恶性B细胞介导的自身免疫性疾病中的应用铺平了道路。使用CAR-T细胞治疗自身免疫性疾病的初步观察表明,这种治疗方法为治疗几种不同的严重自身免疫性疾病提供了一种新的方法。
1.CAR-T细胞治疗的基本原理
CAR 是一种人工跨膜受体,通过基因工程插入免疫细胞(主要是T细胞,但较少使用自然杀伤(NK)细胞,Treg细胞或巨噬细胞),通常使用病毒载体完成。CAR包括一个细胞外区域,由用于抗原结合的免疫球蛋白的单变量链组成,以及一个激活效应细胞的细胞内区域。在第二代CAR-T细胞结构中,这种激活是由CD3 ζ链和CD28或4-1BB共刺激结构域介导的。迄今为止,自身免疫性疾病中最先进的CAR-T细胞治疗方案利用自体T细胞,其中CAR通过慢病毒载体引入。目前用于制造自身免疫性疾病中CAR表达效应细胞的载体如图1所示
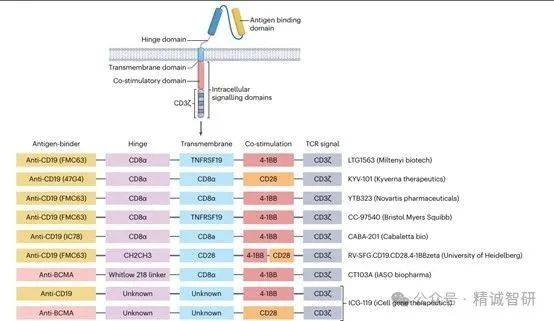
图1:自身免疫性疾病中用于CAR - T细胞生成的载体构建
CAR-T细胞治疗的几个新概念正在进行中,可能会影响未来自身免疫性疾病的治疗(图2)。一种有希望的方法涉及制造和使用来自健康供体、脐带血或诱导多能干细胞的T细胞的异体基因CAR表达细胞。这些“现成的”细胞将随时可供立即使用。关于同种异体CAR表达细胞对急性白血病患者的疗效和耐受性的初步数据已经报道。然而,类似的方法在自身免疫性疾病中的疗效还有待观察。考虑到自身免疫性疾病患者的免疫反应发生改变和/或过度激活,同种异体注射的风险可能与急性白血病患者不同。
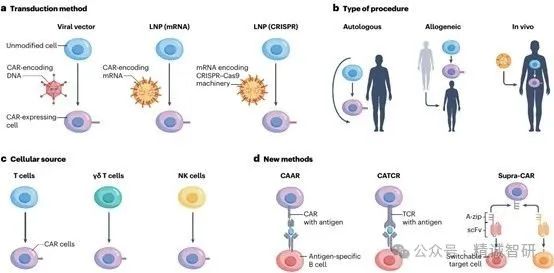
图2:基于CAR-based治疗方法
2.输注后CAR-T细胞介导的B细胞清除
输注后,CAR-T细胞迅速结合并杀死它们的靶细胞(自身免疫性疾病中的B细胞),并进行初始扩增。值得注意的是,CAR-T细胞可以连续有效地与靶细胞结合,一个接一个地消灭细胞,使CAR-T细胞获得了“连环杀手”的绰号。T细胞固有的高迁移能力增强了它们的有效性,并允许在多个靶组织中深度消耗B细胞,包括具有紧密屏障的器官,如睾丸或大脑,这些器官通常会阻止大量药物甚至抗体的进入。组织内B细胞的深度耗竭不仅有利于消除产生自身抗体的浆母细胞,还可以通过废除B细胞的抗原呈递功能和细胞因子的产生来调节局部炎性微环境。通过这种方式,B细胞导向的CAR-T细胞治疗自身免疫性疾病的目的是中断自身抗体的产生,减少自身抗原呈递并可能降低T细胞活化(图3)。
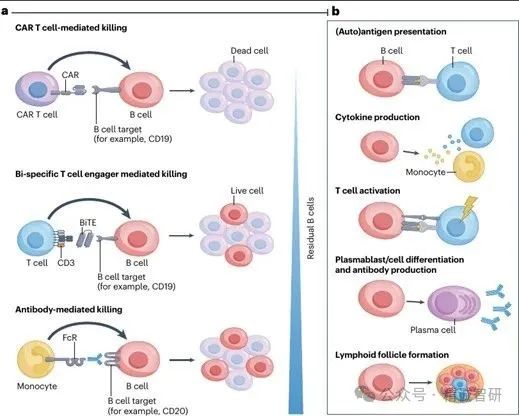
图3:治疗性B细胞耗竭的方法和功能后果
对接受CAR-T细胞治疗的自身免疫性疾病患者的数年随访表明,B细胞重建发生在一定时期后,与CAR-T细胞从外周血中消失的时间点相吻合。这一发现表明,CAR-T细胞在自身免疫性疾病患者中的持续时间有限,这一结果与B细胞恶性肿瘤患者的观察结果截然相反。B细胞的重现和疾病的持续缓解之间的明显的不协调性可以用重建B细胞的幼稚特性来解释,它们可能缺乏自身反应性B细胞克隆。
尽管CAR-T细胞疗法可以为自身免疫性疾病的治疗提供新的可能性,但迄今为止,只有有限数量的患者接受了这种治疗。因此,治疗每一个新患者都需要经历一个陡峭的学习曲线。根据目前自身免疫性疾病中CAR-T细胞治疗的经验,出现了几个需要考虑的重要领域,这些领域将在下面的章节中讨论,包括手术前、手术中和手术后的各个方面。
3.适应症:选择“正确”的疾病
迄今为止,SLE患者和其他自身免疫性疾病如特发性炎症性肌病、系统性硬化症、神经脊髓炎光学光谱障碍,重症肌无力和多发性硬化症已经用靶向B细胞的CAR-T细胞治疗。这些疾病的共同特征是B细胞和自身抗体的形成在其发病机制中起着核心作用。因为深度的B细胞耗竭,包括消除自身反应性B细胞克隆,是CD19或BCMA CAR-T细胞治疗效果的先决条件,只有真正由B细胞驱动的疾病才可能对这种策略有反应。然而,风湿病学中的其他几种疾病,如肉芽肿病合并多血管炎、类风湿性关节炎和原发性Sjögren 's综合征,在其发病机制中显示出B细胞的显著参与,因此可能是B细胞导向的CAR-T细胞疗法的潜在靶标。此外,风湿病以外的自身免疫性疾病,如寻常性天疱疮和原发性硬化性胆管炎,也可能是这种治疗的有希望的适应症。CAR-T细胞的评估,特别是在对照试验中,不仅取决于疾病的病理生理学,还取决于是否存在可测量和可靠的临床终点来确定治疗成功。
4.指示:选择“正确”的患者
在自身免疫性疾病发展的早期阶段,CAR-T细胞主要被用于严重感染、治疗抵抗的患者的救助性治疗,这些患者面临永久性器官衰竭甚至死亡的高风险。目前,CAR-T细胞治疗自身免疫性疾病的“理想”患者是一个不断发展的概念。然而,患有治疗抵抗性疾病且几乎没有器官损伤的患者似乎最有可能获得最大的治疗效益。早期干预CAR-T细胞疗法可以防止永久性器官损伤的发展,这种损伤可能由多种无效药物的循环引起。CAR-T细胞治疗可能导致严重的,潜在的危及生命的不良反应,如细胞因子释放综合征(CRS),免疫细胞相关神经毒性综合征(ICANS)或免疫细胞相关血细胞吞噬样综合征。因此,患者必须有足够的功能器官储备来应对急性不良反应。
如果CAR-T细胞疗法显示出良好的安全性,并在大量自身免疫性疾病患者中实现长期无药缓解,那么在疾病过程的早期使用会对患者及医生有强烈的吸引力。相比之下,可以用常规或生物免疫调节药物有效治疗的轻至中度自身免疫性疾病可能不是CAR-T细胞治疗的理想情景。患者选择的最后一个考虑因素是评估患者的治疗前疫苗状态,因为患者在B细胞发育不全期会经历一段疫苗反应受损的时期。
5.选择细胞治疗的靶点
大多数针对自身免疫性疾病患者的CAR-T细胞疗法都使用了抗CD19 CAR-T细胞。靶向CD19具有几个优势,因为这种细胞表面分子对B细胞谱系具有高度特异性,并且在整个B细胞分化途径中表达,然而,一小部分中枢神经系统细胞也表达CD19,因此,CD19 CAR-T细胞治疗偶尔会发生神经毒性。
先前用于自身免疫性疾病B细胞清除的靶点还包括CD20(例如使用利妥昔单抗)。考虑到CD19在B细胞谱系中广泛表达,而CD20的表达模式更受限制,靶向CD19在治疗自身免疫性疾病方面可能比靶向CD20更具优势。
BCMA在成熟B细胞群中优先表达,包括记忆B细胞、浆母细胞和浆细胞。BCMA CAR-T细胞对浆细胞的消耗可能比CD19 CAR-T细胞有优势。事实上,针对BCMA的CAR-T细胞目前被用于多发性骨髓瘤的治疗。尽管基于BCMA的浆细胞靶向可能清除产生自身抗体的浆细胞,但这种方法也会显著影响在接种疫苗和感染后产生针对病毒和细菌的保护性体液反应的浆细胞。总的来说,CD19和BCMA的双重靶向或BCMA的单一靶向可能适用于自身免疫性疾病患者亚组,其中自身抗体的产生主要由浆细胞驱动。这些患者可以通过评估CD19 CAR-T细胞治疗后复发的患者来识别,这一特征可能与持续的自身抗体产生有关。
CAR-T细胞的另一个有趣靶点是CD38,这是一种细胞表面蛋白,在浆细胞、早期B细胞、T细胞亚群和NK细胞上表达。与CD19相比,靶向CD38提供了不同的靶细胞谱。这种方法潜在地结合了靶向抗体产生细胞和在分化早期消耗B细胞而不影响成熟B细胞的优势。
展望未来,CAR-Treg细胞可以在不消耗B细胞的情况下提供更多的机会来解决自身免疫性疾病。然而,这种方法在自身免疫性疾病患者中的疗效尚不清楚。事实上,考虑到Treg细胞的可塑性,对该疗法在临床的运用还需要更多的研究数据来支持。
6.淋巴耗竭的作用
通过促进抗原识别后CAR-T细胞的稳态扩张,淋巴细胞耗竭被认为是CAR-T细胞成功治疗的关键组成部分。淋巴细胞的减少使得CAR-T细胞有更多的机会利用患者体内的细胞因子,并允许少量过继性转移的CAR-T细胞扩增并深入消耗所有体区室的B细胞。CAR-T细胞的获取、数量和/或功能不足将阻碍这一目标的实现。
最常用的淋巴消耗疗法是环磷酰胺(通常为0.75-1.5g/m2)和氟达拉滨(通常为75-90mg/m2)的联合治疗。该方案是B细胞恶性肿瘤中有效的抗CD19 CAR-T细胞治疗所必需的。淋巴细胞消耗疗法对于自身免疫性疾病的CAR-T细胞治疗成功是否必要尚不清楚。事实上,观察到CAR-T细胞在自身免疫性疾病治疗过程中迅速消失,B细胞在平均3个月后重新出现,这表明CAR-T细胞在自身免疫性疾病患者中被释放到竞争环境。此外,在自身免疫性疾病的情况下,提供给CAR-T细胞的抗原刺激比在恶性疾病的情况下要低,这可能会加速CAR-T细胞群的收缩,突出了在这种情况下稳态增殖的重要性。
虽然在使用CAR-T细胞治疗自身免疫性疾病时停止淋巴消耗疗法可能不可取,但减少剂量是可行的。然而,在自身免疫性疾病的治疗中,替代药物的必要性尚不清楚,特别是考虑到迄今为止观察到的细胞因子释放综合征和免疫细胞相关神经毒性综合征的发生率低于治疗B细胞恶性肿瘤。
淋巴细胞耗竭可能在一定程度上支持CAR-T细胞疗法在自身免疫性疾病治疗的早期阶段的疗效,但这种方法不太可能有助于长期无药物缓解。现有数据表明,淋巴消耗疗法可能是有效的CAR-T细胞治疗自身免疫性疾病的一个重要方面,尽管可能在不损害自身免疫性疾病疗效的情况下潜在地减少剂量。重要的是,短暂的淋巴细胞清除疗法不足以解释CAR-T细胞疗法持续的中期和长期有益效果。
7.CAR-T细胞治疗后的患者监测
长期随访对所有接受CAR-T细胞治疗的患者至关重要,包括那些因自身免疫性疾病等适应症接受实验性治疗的患者。CAR-T细胞扩增可以通过流式细胞术或CAR构建特异性实时PCR来评估。定期监测B细胞对于检测它们的消耗和再现也是必不可少的,这与CAR-T细胞动力学一起,是治疗效果的良好替代指标。CAR-T细胞治疗最相关的中期不良反应是感染。如有需要,应测量血清免疫球蛋白水平,以指导免疫球蛋白替代。自体免疫性疾病患者CAR-T细胞治疗后的另一个重要方面包括监测器官功能和评估额外的免疫参数。虽然对B细胞和T细胞谱系的详细分析超出了常规临床监测的范围,但应反复测量自身抗体,以检查其水平是否下降甚至血清转化。CAR-T细胞输注后的所有患者都需要长期随访,这对于治疗自身免疫性疾病等仍处于实验阶段的方法尤为重要。
8.在使用CAR-T细胞之前、期间和之后的伴随治疗
在CAR-T细胞治疗的背景下,伴随治疗,包括免疫调节治疗,被运用以提高安全性和有效性。这些变化包括在CAR-T细胞治疗前逐渐减少常规免疫调节治疗,在CAR-T细胞治疗期间控制毒性,以及CAR-T细胞治疗后潜在的复发。
9.1逐渐减少免疫抑制和桥接治疗
环磷酰胺、霉酚酸酯和钙调磷酸酶抑制剂等疗法是治疗自身免疫性疾病的主要方法。此外,患者经常长时间接受糖皮质激素治疗,特别是当他们的疾病仍然控制不佳时。这些药物会影响T细胞的数量和功能,潜在地影响CAR-T细胞产物的适当制造或质量。因此,目前开发CAR-T细胞的策略包括通过暂停非糖皮质激素药物和逐渐减少糖皮质激素。这种方法有增加疾病活动性甚至自身免疫性疾病爆发的风险。因此,在CAR-T细胞可用之前,可能需要“桥接”治疗来维持对自身免疫性疾病活动的控制。糖皮质激素可能是这种桥接干预的最佳选择。
9.2保存生育能力
由于许多自身免疫性疾病患者是育龄的年轻女性,因此保存生育能力至关重要。与癌症患者相比,自身免疫性疾病患者通常更年轻,预期寿命更长,在CAR-T细胞治疗之前,通常会接受更温和、性腺毒性更小的治疗。此外,CAR-T细胞治疗后持续的无药物缓解使患者在计划生育方面具有更大的灵活性。
9.3预防感染和癫痫发作
CAR-T细胞疗法通常伴随着抗病毒和抗菌预防。然而,自身免疫性疾病患者是否从中获益尚不清楚。
9.4伴随的免疫抑制
在CD19 CAR-T细胞输注后,实现深度B细胞消耗,适应性免疫仅依赖T细胞一段时间,通常是几个月,直到B细胞恢复。迄今为止,几乎所有接受CAR-T细胞治疗的自身免疫性疾病患者的免疫抑制都已停止。在这种情况下,由于机会性感染的高风险,应避免B细胞和T细胞联合消耗和/或抑制。
9.5耀斑和疾病复发的管理
到目前为止,CD19 CAR-T细胞治疗后尚未发生自身免疫性疾病的发作,但这种发作仍然是可能的。CAR-T细胞治疗后疾病发作或复发可能需要重新启动免疫抑制甚至第二次CAR-T细胞输注。耀斑的管理取决于潜在的疾病和耀斑表现的强度。在决策过程中,还应考虑先前的CAR-T细胞治疗使患者对先前无效的常规免疫抑制疗法更敏感的可能性。
10.CAR-T细胞相关毒性
CAR-T细胞治疗的短期毒性是由CAR-T细胞诱导的炎症驱动的,主要是由免疫细胞来源的细胞因子引起。到目前为止,在CAR-T细胞治疗的自身免疫性疾病患者中观察到的严重毒性非常罕见。目前还没有免疫细胞相关的血液毒性或免疫效应细胞相关的噬血细胞淋巴组织细胞增多症样综合征的病例报道。最重要的是,没有观察到会对患者构成相当大威胁的更高级别的细胞因子释放综合征。
在CAR-T细胞输注后的头10-14天内对患者进行仔细监测是必要的。这种监测包括记录重要参数(如体温、心率、血压和氧合)和测量炎症标志物,如c反应蛋白、IL-6和铁蛋白水平。这种方法尤其重要,因为患有自身免疫性疾病的患者通常有重要器官功能受损,包括心脏、肾脏和肺部,器官“储备”减少。在这些患者中,CRS可能会增加器官衰竭的风险。ICANS在自身免疫性疾病患者的治疗中几乎不存在。尽管如此,还是建议进行仔细的神经监测。除了CRS和神经毒性外,严重的、特别是持久的血液学毒性是CAR-T细胞疗法相关的一个显著不良反应。
对接受CAR-T细胞治疗的自身免疫性疾病患者进行长期监测至关重要。成功的CAR-T细胞疗法甚至可能通过潜在地消除长期免疫抑制的需要来降低感染的风险。值得注意的是,在接受CAR-T细胞治疗的血液系统恶性肿瘤患者中已经报道了继发性癌症。这些癌症并不归因于CAR-T细胞治疗。如果在CAR-T细胞治疗后确实发生T细胞恶性肿瘤,调查应包括载体拷贝数和整合位点的分析,以及T细胞淋巴瘤中CAR 转基因的检测。
11.其他挑战和注意事项
缺乏对照临床试验结果限制了得出关于CAR-T细胞治疗自身免疫性疾病的治疗价值和风险概况的明确结论的能力。重要的是,确保CAR-T细胞疗法获得批准的最有希望的临床发展途径尚未确定。由于CAR-T细胞疗法是一种复杂的治疗方法,这种方法不能简单地复制用于自身免疫性疾病的常规治疗方法。必须综合考虑风险收益和可行性方面的因素。还需要考虑CAR-T细胞治疗的成本。需要建立药物经济学模型来确定盈亏平衡点,在这个平衡点上,持续用药、进行性残疾、因持续免疫抑制导致的活动性疾病住院或并发症以及需要血液透析或手术等支持措施的器官衰竭的累积成本都是需要考量的重要因素。对CAR-T细胞治疗的患者进行长期观察,并记录他们持续的无药物缓解或复发,将有助于形成这样的模型。
12.结论
CAR-T细胞治疗已显示出在几种不同形式的自身免疫性疾病中诱导长期无药物缓解的希望。目前的CAR-T细胞治疗方法侧重于靶向B细胞,从而治疗自身抗体介导的疾病,如SLE和特发性炎症性肌病。迄今为止的研究选择了多药物耐受的自身免疫性疾病患者进行CAR-T细胞治疗。然而,高风险患者的早期治疗也可以预防不可逆的器官损伤。如果CD19靶向的CAR-T细胞疗法产生的反应不足,则可以考虑替代靶标,如BCMA或CD38。减少用于淋巴细胞清除的剂量可能会减轻长期毒性,包括继发性恶性肿瘤的风险。尽管到目前为止显示出普遍有利的毒性特征,但强烈建议对暴露于CAR-T细胞的自身免疫性疾病患者进行长期监测。此外,在疾病复发之前避免额外的免疫抑制对于维持足够的免疫能力水平至关重要。目前,没有证据表明使用CAR-T细胞治疗的自身免疫性疾病患者发生继发性恶性肿瘤的风险很高。解决本综述中概述的问题对于最大限度地发挥CAR-T细胞治疗自身免疫性疾病的治疗潜力和最大限度地降低治疗风险至关重要。由于自身免疫性疾病的CAR-T细胞疗法尚处于早期阶段,这些概念仍在不断发展,关于这种疗法的影响、安全性和长期疗效还有很多需要了解的方面。最终,CAR-T细胞疗法的使用也将受到监管机构的指导。
Reference:
Georg Schett et al., Nature Reviews Rheumatology, 2024(20):531, Advancements and challenges in CAR T cell therapy in autoimmune diseases.
