精诚智言:特发性肺纤维化及化学诱导性动物模型
特发性肺纤维化(Idiopathic pulmonary fibrosis,IPF)是一种病因不明的慢性进行性且无法逆转的间质性肺炎(Idiopathic interstitial pneumonia,IIP),临床主要表现为严重咳嗽、胸闷憋喘、呼吸困难和肺通气功能降低,甚至呼吸衰竭,患者生存质量严重受损。调查报告显示,IPF患病率在亚太国家为(0.57~4.51)/万人,在欧洲国家为(0.33~0.51)/万人,在北美为(2.40~2.98)/万人。2015-2022年,中国IPF的患病人数从21.7万人增长至26.4万人,复合年增长率为2.8%。预计到2032年,中国IPF的患病人数将达到33.1万人。IPF 患病人群主要为中老年人,在未经治疗的情况下,IPF患者从确诊到死亡的中位生存时间为3~4年。病理特征主要为肺泡上皮重复性异常瘢痕形成,以及间质、远端呼吸道和肺泡腔的重塑,这些改变会导致细胞外基质(Extracellular matrix, ECM)积聚和病理性肺重塑(Fig. 1)。

Fig. 1:特发性肺纤维化
IPF的发病是由多种因素介导,例如遗传因素、环境影响、职业危害和不良生活习惯等均可能导致IPF的发生。但是,截至目前其发病机制尚未完全阐明。近年来,对IPF的认识已经从炎症驱动的疾病逐渐转变为肺泡上皮细胞损伤修复驱动的疾病。研究认为,上皮修复是IPF的主要发病原因,肺泡上皮细胞、成纤维细胞、肌成纤维细胞发挥着重要作用,三者之间形成的促纤维化级联是IPF的关键过程。
目前关于IPF发病机制的研究主要集中在巨噬细胞极化失衡、氧化应激和肺泡上皮-间质转化(Epithelial-mesenchymal transition,EMT)等方面。机体长期暴露于含有多种危险因素的环境中,会导致肺损伤,诱发异常的炎症反应和氧化应激,两者可相互促进。炎症反应中的巨噬细胞(Macrophage,Mø)分化为M1型和M2型两种不同的状态,M1型巨噬细胞可诱导产生的促炎因子,例如白介素-1β(Interleukin-1β,IL-1β)、IL-6和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)会加快炎症产物对肺组织的浸润。氧化应激通过氧化还原激活核转录因子-κB(nuclear transcription factor,NF-κB)信号通路释放 TNF-α、IL-1β 和 IL-6 等炎症因子激活EMT,并导致M2型巨噬细胞极化。M2型巨噬细胞及其亚型产生的转化生长因子-β1(Transforming growth factor-β1,TGF-β1)、血小板衍生生长因子(Platelet-derived growth factor,PDGF)、血管内皮生长因子(Vascular endothelial growth factor,VEGF)等促肺纤维化因子来介导胶原蛋白沉积和EMT。EMT与成纤维细胞相互作用,诱导肌成纤维细胞大量形成、肺上皮细胞中胶原蛋白和ECM等物质产生,最终导致肺纤维化(Fig. 2)。不过,可能还存在其他方面的病理机制,因此进一步研究IPF的发病机制对开发有效的治疗手段,延缓IPF疾病进程、改善预后及提高生存率极为重要。
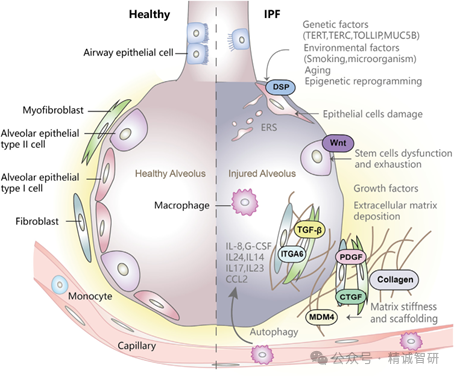
Fig. 2: 特发性纤维化的发病机制
目前IPF临床治疗方式较为局限,主要目的为延缓疾病进展。治疗方法包括氧疗、使用糖皮质激素、免疫抑制剂和抗纤维化药物,以及预防深静脉血栓形成。美国食品药品管理局(Food and drug administration,FDA)批准的为吡非尼酮(Pirfenidone)和尼达尼布(Nintedanib)两种药物进行抗纤维化治疗,但只能缓解肺纤维化进程。肺移植作为唯一根治手段,存在肺源不足、费用高昂、术后排斥反应大、并发症多等弊端。因此,开发出安全有效的治疗IPF药物是当前整个社会共同面对的问题。
在药物研究领域,动物模型是一个不可或缺的重要环节。动物模型在模拟临床相关疾病、进行药物治疗干预及观察相应疗效的过程中尤为重要。选用合适的实验动物是成功建立疾病模型的基础,关注动物的种属、性别、周龄、习性特征等。当前用来诱导建立IPF模型的动物主要包括小鼠、大鼠、仓鼠、树鼩、美利奴羊、恒河猴、叙利亚仓鼠等。根据美国胸科协会(American thoracic society,ATS)研讨会报告,肺纤维化临床前测试的动物首先选择是小鼠,其次是大鼠。鼠类与人类有大约90%的相似基因,在众多的生理病理过程中可能与人类极为相似。鼠类模型因其个体相似度高、造模周期短、实验效率高、价格低廉及可重复性好等优势,是实验应用最多的造模动物,但是鼠类同时也存在死亡率高、不能重复采样、体型小故不适用于放射影像学的研究等缺陷。目前构建IPF疾病模型常用的大鼠有SD大鼠和Wistar大鼠,小鼠有C57BL/6小鼠、ICR小鼠、BALB/c小鼠和KM小鼠。Wistar大鼠性格较为温顺,抗病能力强且自发性肿瘤的发生率低;而SD大鼠是用Wistar大鼠培育而成的,其适应性和抗病能力更强,尤其是对呼吸系统疾病抵抗力较强。小鼠中C57BL/6品系在造模过程中对博来霉素(Bleomycin,BLM)和百草枯(Paraquat,PQ)的敏感性均比ICR小鼠和KM小鼠高。与鼠类相比,兔、犬、羊等动物体型大小适中,心脏结构和血液循环系统与人类较为相似,更适合心血管疾病的实验研究,但兔、犬、羊等动物肺内结构显示清楚、高分辨计算机体层X线摄影术(High-resolution computed tomography,HRCT)等影像学形态与人类更接近,更易观察肺内结构组织变化,且可以大量采集组织样本,减少因动物过小而带来的操作难度和组织样本误差。
IPF动物模型的诱导方法众多,不同化学诱导手段都存在各自的优点与局限性(Tab. 1)。主要方法包括BLM诱导、石棉(Asbestos)/二氧化硅(Silicon dioxide,SiO2)诱导、PQ诱导和异硫氰酸荧光素(Fluorescein isothiocyanate,FITC)诱导等。BLM诱导的IPF大鼠肺部病理变化早期以肺泡炎症改变为主,晚期以肺间质纤维化为主。石棉的主要成份为SiO2,长时间暴露于SiO2,会导致SiO2在肺中沉积,引起炎症细胞浸润、肺泡破坏等病理改变,最终形成纤维化结节。SiO2诱导产生的肺纤维化结节类似于暴露于粉尘或微小颗粒的肺纤维化结节,更接近于矽肺(Silicosis)模型。PQ作为一种毒性较强的除草剂,进入机体后会导致机体出现氧化应激、炎症损伤等表现,最终引起多器官衰竭甚至死亡,因其造模死亡率高,现已多用于PQ毒性的研究。FITC可作用于气道,作为半抗原与其他的肺组织蛋白结合,通过趋化因子受体与配体的相互作用使纤维细胞进入肺,诱导肺纤维化。由于超声处理的FITC颗粒大小不一,致使其诱导的纤维化反应程度可变性过大,现在已经很少应用于IPF模型建立。
在各种诱导性IPF模型中,BLM诱导模型目前应用最多。BLM 诱导方法操作简便、造模成功率高、可重复性好、病理表现与人类 IPF最为相似。美国ATS的一份报告证实,BLM诱导模型是最佳特征动物模型。在使用BLM诱导模型时,相较于雌鼠,雄鼠对BLM的反应更为强烈,是更加理想的模型动物。如何构建一个与人类IPF相似的实验动物模型依然面临重大考验,造模方法选择的不同和操作的差异均会影响模型的最终情况。
Tab.1:化学诱导性IPF动物模型的优点、局限性和适用情况

综上,在化学诱导性IPF动物模型中,大鼠和小鼠因其饲养简单、价格低廉、个体差异性小等优点被大多数研究者所选择。当前各种IPF诱导模型的病理表现都与人类存在一定的差异,无法完全复制人类间质性肺炎进行性和不可逆性特征,而且在建模过程中并无明确的操作流程及药物剂量规定,造模结束后的具体评估方法也没有标准化、规范化,所以还需要不断完善并探索新的规范化的IPF动物模型建立方法。上海精诚智研生物医药有限公司技术团队采用BLM诱导小鼠成功构建了稳定的IPF模型,实验数据展示如下:
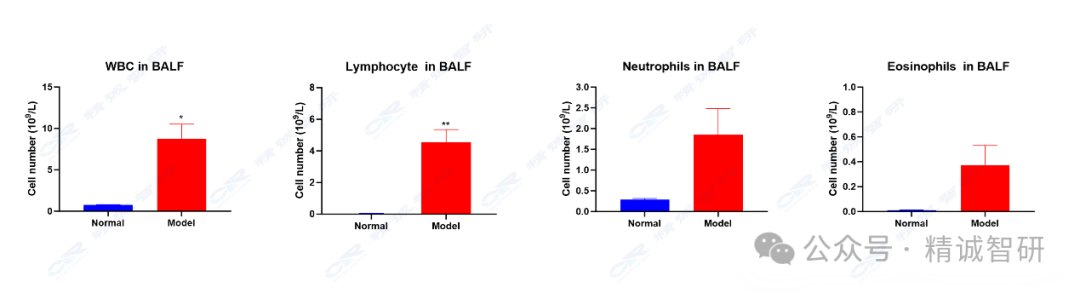
1. 肺灌洗液免疫细胞检测结果
2. 肺功能检测结果

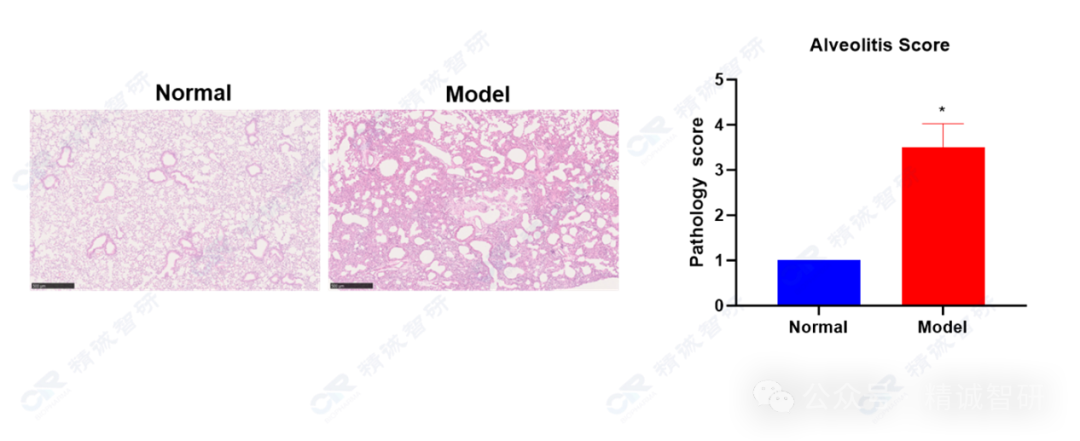
3. 肺组织HE染色检测结果
4. 肺组织Masson染色检测结果

另外,精诚智研团队在免疫和炎症性疾病动物模型领域深耕多年,积累了丰富的模型开发和药物研究经验。团队构建了银屑病、多发性硬化、系统性红斑狼疮、类风湿关节炎、特应性皮炎、炎症性肠病等60多种不同类型的疾病动物模型,为临床前药效评价提供针对不同靶点或通路的免疫和炎症性疾病相关动物模型。针对客户的差异化需求,团队可提供模型定制服务,为客户开发合适的动物模型并制定合适的体内药效学研究方案。

参考文献:
[1] Maher TM, et al. Global incidence and prevalence of idiopathic pulmonary fibrosis. Respir Res. 2021; 22(1): 197.
[2] Martinez FJ, et al. Idiopathic pulmonary fibrosis. Nat Rev Dis Primers. 2017; 3: 17074.
[3] Mei Q, et al. Idiopathic pulmonary fibrosis: an update on pathogenesis. Front Pharmacol. 2022; 12: 797292.
[4]张震,等. 特发性肺纤维化动物模型及中药干预作用的研究进展. 中国实验动物学报. 2025; 1-16.
[5]檀丽丽,等. 特发性肺纤维化动物模型的研究进展. 中国实验动物学报. 2025; 1-12.
