精诚智评:TNF-TNFR超家族成员相关的药物开发
今天咱们继续聊聊细胞因子。这次的主角可谓鼎鼎大名,是自免和炎症领域的绝对王者。
1975年E.A. Carswell等人发现接种卡介苗的小鼠注射LPS后,血清中出现一种能使多种肿瘤发生出血性坏死的物质,将其命名为肿瘤坏死因子(tumor necrosis factor,TNF)。TNF-α 是第一个被鉴定出的TNF超家族蛋白,随后根据与TNF-α的序列同源性又鉴定了多个相关蛋白。TNF超家族蛋白主要由抗原呈递细胞(APC)表达,如树突状细胞(DC)、巨噬细胞、B 细胞和中性粒细胞,但也可由T细胞、自然杀伤细胞(NK)、嗜碱性粒细胞、嗜酸性粒细胞、肥大细胞、内皮细胞和胸腺上皮细胞表达。
TNF 超家族成员结合到属于TNF受体超家族(TNFRSF)的受体上,该家族在人类中有 29 种受体,在小鼠中有 32 种。除了BAFFR、BCMA、TACI和XEDAR为Ⅲ型跨膜蛋白外,TNF受体超家族是Ⅰ型跨膜蛋白或可溶性诱饵受体。所有TNF受体的胞外域都具有一种或多种高度保守的、富含半胱氨酸的结构域,该结构域介导配体结合。TNFSF 三聚体与其受体的高亲和力结合促进了受体聚集和三聚化,形成一个 3:3 的六聚体配体-受体复合物并激活下游信号传导途径。几个TNF超家族配体可以结合多个受体,形成了一个复杂的网络,能够介导免疫反应和炎症。
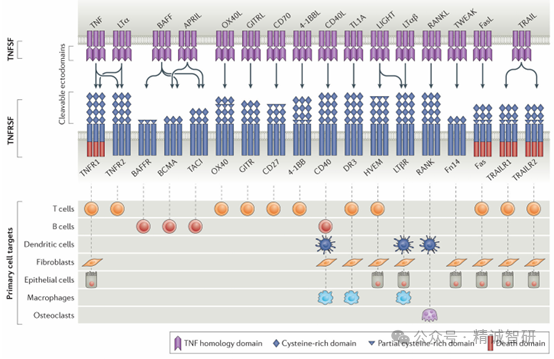
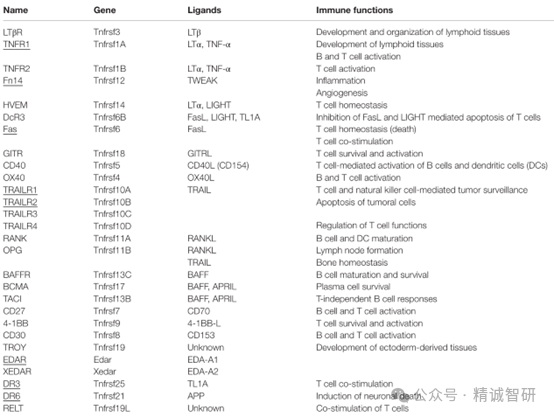
鉴于TNF及其受体超家族成员在免疫系统中的重要作用,家族内的多个成员已经成为自身免疫性疾病、移植物排斥反应、肿瘤免疫治疗、糖尿病等多种人类疾病的热门靶点并在临床试验中显示出卓越的疗效。
TNF-α
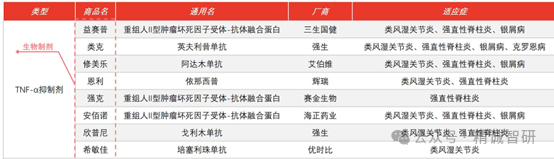
TNF-α是家族成员里当之无愧的当家花旦。针对TNF-α开发的抑制剂开创了自免领域生物制剂的新时代。这些药物包括西普类融合蛋白(依那西普)和多款单克隆抗体(英夫利西单抗、阿达木单抗、戈利木单抗)。传奇药物修美乐(阿达木单抗)作为第一款全人源单克隆抗体药物,自上市以来,已获批的适应症包括类风湿型关节炎(RA)、强直性脊柱炎(AS)、银屑病(包括儿童斑块状银屑病)、银屑病关节炎、幼年特发性关节炎(JRA)、克罗恩病(包括儿童克罗恩病,CD)、溃疡性结肠炎(UC)、化脓性汗腺炎、葡萄膜炎等十七种疾病。修美乐从2012年开始登顶全球药物销售榜榜首,到2021年被辉瑞/BioNTech的新冠mRNA疫苗超越,连续九年占据了全球药王宝座。2021和2022年,修美乐的全年销售额均超过200亿美元,达到销售峰值。目前,修美乐已成为多种自免疾病治疗的基石,尤其是在中重度患者或者激素不耐受患者的治疗方案中占据绝对的比重。
TNFR2
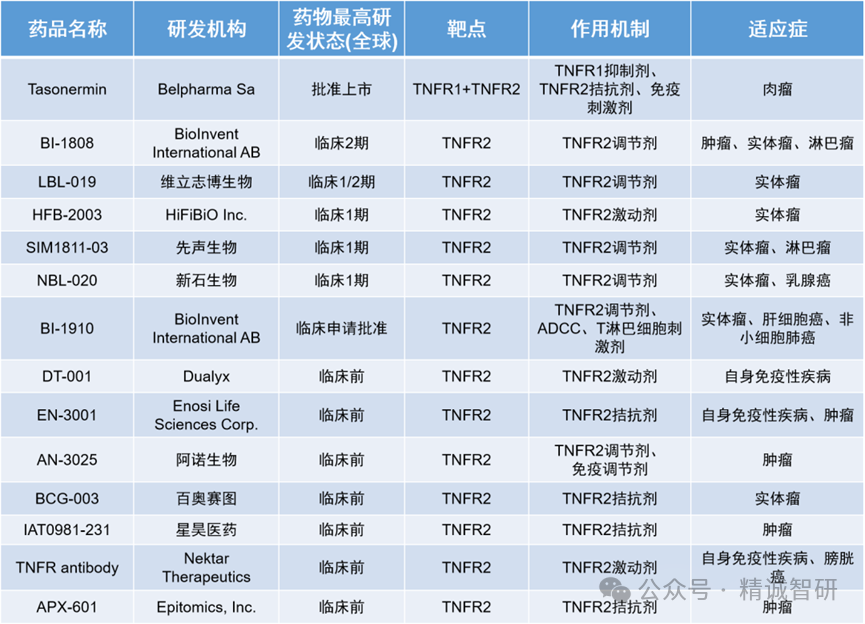
在肿瘤微环境中,TNFR2表达在抑制性免疫细胞中,包括调节性T细胞(Treg)和髓源抑制性细胞(MDSC)。TNF-TNFR2 的相互作用会促进 Treg 细胞的活化和增殖,从而抑制效应T细胞(Teff)的功能并辅助肿瘤的免疫逃避。在急性髓细胞白血病(AML)、肺癌和卵巢癌等多种肿瘤中,异常升高的TNFR2+ Treg亚群能够参与形成免疫抑制性的肿瘤微环境,削弱机体的抗肿瘤免疫反应,协助肿瘤的免疫逃逸。
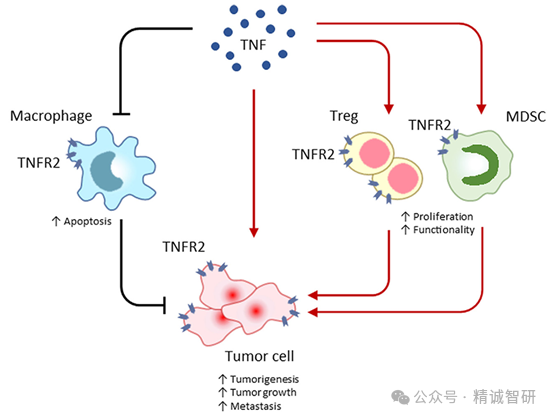
利用单克隆抗体阻断TNF-TNFR2的相互作用能够抑制Treg细胞的活化,导致其数量和功能的降低,从而有利于抗肿瘤免疫应答。因此,TNFR2拮抗剂是一种极具潜力的肿瘤免疫治疗手段。目前已有多家企业开发了针对TNFR2的抗体用于肿瘤免疫治疗。但其MOA尚不十分明确,到底是开发阻断型抗体还是开发具有ADCC功能的抗体来清除肿瘤微环境中的Treg,目前尚有争议,需等待更多的研究和临床数据给予证实。
BAFF
BAFF(也称为TNFSF13B、CD257)是一种关键的B细胞生存因子。BAFF在单核细胞、DC和骨髓基质细胞在内的各种细胞类型上均有表达,其受体有3种:TACI,BCMA和BAFFR。BAFF通过与其受体的结合在支持B细胞的存活和增殖、调节类别转换重组以及自身免疫性B细胞的选择等方面发挥关键作用;此外,有研究发现BAFF也能促进T细胞的活化、增殖和分化。
贝利尤单抗(Belimumab)是一种特异性识别和抑制BAFF生物活性的人源化单克隆抗体,能显著降低循环B细胞水平。贝利尤单抗静脉(IV)制剂于 2011 年 3 月在美国批准用于治疗成人 SLE,开创了SLE靶向治疗的新纪元。
BCMA
BCMA(又称TNFRSF17或CD269)主要表达于成熟B淋巴细胞及浆细胞表面,是一种B淋巴细胞成熟的标志蛋白。
西达基奥仑赛(cilta-cel)是一款靶向BCMA的CAR-T产品,由传奇生物与强生旗下杨森制药共同开发。关键性1b/2期 临床CARTITUDE-1研究结果显示,Cilta-cel在既往接受过四种或者以上治疗(包括蛋白酶体抑制剂、免疫调节剂和抗CD38单克隆抗体)的复发或难治性多发性骨髓瘤(MM)患者中显示出高达98%的总缓解率。2022年2月28日,Cilta-cel被FDA正式批准。2023年,Cilta-cel全年销售额超5亿美元,预计2024年将超10亿美元。传奇生物也成为全球市值第一的细胞治疗生物企业,成就传奇。
靶向BCMA的药物还有2款BCMA×CD3双抗,分别于2022年8月和2024年2月获批。未来MM领域CAR-T和双抗疗法将直面竞争,对药物的有效性、安全性和持续缓解能力提出了更高的要求。
OX40
OX40,又名TNFR4,主要表达于活化的CD4+、CD8+ T细胞和Treg细胞表面。OX40的配体OX40L,主要表达于APC,同时在NK细胞、肥大细胞和激活的T细胞上也有表达。
在全民肿瘤免疫时代,OX40激动剂抗体的研发可以说是热火朝天,频频出现在各大MNC公司的管线中。然而,疗效的缺失和潜在副作用的担忧,使得OX40激动剂出师未捷。2019年1月,辉瑞宣布放弃OX40抗体的开发,此后各家纷纷中止OX40激动剂抗体的研发,目前市面上基本已经看不到其身影。
然而,当上帝关上一扇门,祂便会打开一扇窗。OX40靶点在自身免疫性疾病领域似乎有了峰回路转的可能。目前在研的两款OX40抑制剂药物在治疗中重度特应性皮炎的2期临床试验中均获得成功,达到主要终点和关键次要终点。
在肿瘤领域落寞离场,在自免领域却转身拥抱希望,这大概这就是创新药研发的魅力所在。
GITR
GITR,又名TNFRSF18。GITR主要表达于胸腺、脾和淋巴结中的T淋巴细胞,在小鼠中GITR持续高表达于Treg细胞,尽管静息状态的NK细胞、Teff细胞、B细胞中GITR表达水平很低,但细胞活化后GITR表达显著增加。GITRL主要表达于APC,包括内皮细胞、DC、巨噬细胞等。
然而,GITR激动剂的开发也因为临床疗效的缺失而无疾而终。临床前优异的单药和联合用药疗效未能转化成临床获益,原因可能在于鼠源和人源T细胞激活后表面共刺激受体表达的时空特异性存在差别。另外,GITR同时在Teff和Treg表达,也存在着靶点特异性差的问题,从目前的研究来看,基本上没有药物在肿瘤免疫相关的临床试验中达到既要激活Teff又要抑制Treg的效果,后续的靶点选择和MOA研究应引以为鉴。
CD70-CD27
CD70(又称TNFSF7)是一种II型跨膜蛋白,与受体CD27作用后可促进T细胞和B细胞的活化、增殖及分化,在调控免疫应答过程中发挥重要作用。正常情况下CD70主要在活化的淋巴细胞表达,病理情况下CD70可高表达于多种肿瘤组织,并导致免疫功能耗竭,诱导免疫逃逸。
研究显示,CD70-CD27轴可促进Treg存活、增殖以及Teff细胞的衰竭和凋亡。该轴也参与NK细胞的消耗和TAM的迁移、激活。此外,肿瘤细胞表达的CD70可通过多种途径影响T细胞的命运: (1)通过慢性共刺激促进T细胞耗竭;(2)通过上调CD95L和/或CD95诱导T细胞凋亡;(3)触发Treg扩增。
目前全球CD70 在研疗法以 CAR-T/NK 、单抗和ADC 为主,大部分尚处于早期临床。因为CD70在多种肿瘤细胞中的高表达,ADC可能是最能体现临床获益的药物形式。
4-1BB
4-1BB的全称是TNFRSF9,又称CD137,最初从活化的T细胞中发现。4-1BB在整个造血和非造血细胞中广泛表达。
4-1BB激动性抗体在既往临床前和早期临床研究中显示出潜力,然而,更多的临床开发却止步于有限的治疗窗。在肿瘤免疫领域,无论是单抗联合PD-(L)1类抗体,还是双特异性抗体均未在临床中展示显著疗效。此类共刺激信号分子的表达不够广谱,且与T细胞激活条件和细胞因子的种类和浓度紧密相关,而且不同患者肿瘤微环境中此类分子在T细胞表面的比例和表达丰度差异性极大,也没有很好的生物标志物对患者进行分层,这些因素都为临床方案的制订和实施带了极大挑战,最终为临床失败埋下祸根。
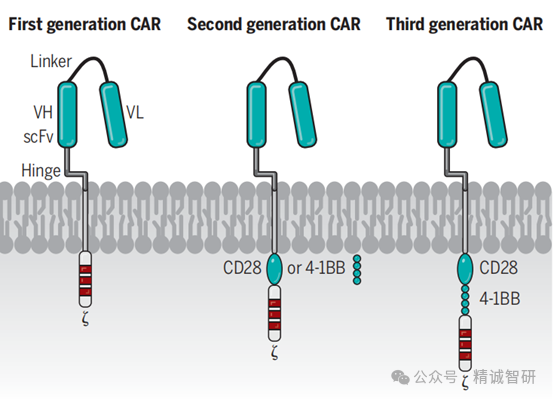
4-1BB成名的更大原因在于它的胞内信号传导结构域是跨时代治疗产品CAR-T结构中的重要组成部分。CD28和4-1BB是最常用的两种CAR的共刺激分子结构域,其中4-1BB使用更为广泛。之前的研究提示4-1BB CAR-T在体内会有更长的存活时间。最近Carl H. June实验室发表在Science Signaling的文章,细致的阐述了4-1BB通过非典型NF-κB信号通路,抑制促凋亡蛋白Bim表达,从而促使CAR-T在体内存活更久的内在机制。
CD40-CD40L
CD40又称TNFRSF5,在APC,如B细胞、DC、单核细胞以及许多非免疫细胞中表达。CD40是连接先天免疫和适应性免疫的关键介质。
目前,针对CD40-CD40L的药物开发主要集中在单克隆抗体上。大多数抗体研究都聚焦于CD40激动剂(Agonists)和拮抗剂(Antagonists)。激动剂主要用于肿瘤领域的治疗,而拮抗剂则被用于治疗自身免疫性疾病等病症。在过去二十年中,由于剂量限制性副反应的影响,CD40激动剂的研发不尽如人意,导致包括罗氏、艾伯维和诺华等多家MNC在这一领域折戟沉沙。
CD40-CD40L信号在B细胞发育,尤其在生发中心中B细胞成熟和受体编辑中发挥重要作用。CD40-CD40L过度表达激活,是多种自身免疫性疾病的发病基础。CD40或CD40L抑制剂抗体,在临床上已被用于开发SLE、RA、CD、银屑病、移植物排斥等多项自免适应症。
2023年1月19日,Horizon Therapeutics宣布在研CD40L拮抗剂dazodalibep在治疗干燥综合征(Sjögren’s syndrome)的2期临床试验中,在第二部分患者群体中达到临床主要终点。基于这些结果,该公司即将设计和启动3期临床开发项目,成为全球首个挺进3期临床的CD40L药物。
2024年2月15日,赛诺菲宣布其潜在“best-in-class”单抗药物frexalimab用于治疗多发性硬化(MS)患者的2期试验的积极结果发表于《新英格兰医学杂志》上。该研究表明frexalimab可显著减缓复发性MS患者的疾病活动。目前赛诺菲已启动frexalimab治疗复发性MS和非复发性继发进展性MS的3期临床试验。
TL1A
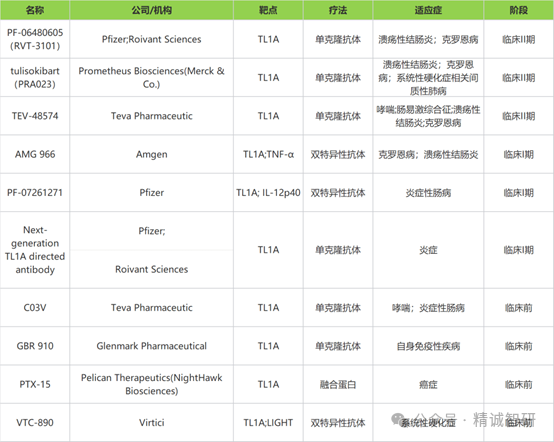
2023年6月22日,Roivant Sciences宣布RVT-3101在治疗UC的2b期临床试验中获得积极长期结果:接受治疗的患者,在56周时临床缓解率达到36%,比14周(29%)时进一步提升。获得内镜改善的患者比例在56周时达到50%,比14周(36%)时也有大幅度提高。2023年10月23日,罗氏宣布收购Roivant子公司Telavant及其药物管线RVT-3101。根据协议条款,罗氏将预付71亿美元的收购价格和1.5亿美元的近期里程碑付款。
2023年4月16日,MSD以108亿美元收购Prometheus公司,将其主打产品TL1A抗体PRA-023收入囊中。2024年9月25日,PRA-023在中重度UC的临床2期结果发表在《新英格兰医学杂志》上,目前该项目已进入临床Ⅲ期。
2023年10月4日,赛诺菲和Teva宣布达成合作协议,共同开发和商业化TL1A单抗TEV-574。2024年12月17日,TEV-574在针对UC和CD的临床2期试验中达到主要终点。
2024年6月13日,明济生物宣布将临床前TL1A抗体的全球权益授权给艾伯维,并将获得1.5亿美元预付款和近期里程碑付款,以及预期15.6亿美元里程碑付款,两位数比例的潜在销售分成。
凭借着这一系列BD交易,TL1A靶点成为自免领域当之无愧的当红炸子鸡。
TL1A,又称TNFSF15,在不同的免疫细胞中表达,如单核细胞、巨噬细胞、DC、T细胞,以及非免疫细胞,例如滑膜成纤维细胞和内皮细胞中表达。
研究发现,TL1A在自免疾病中异常表达,并参与RA、银屑病和IBD等自免疾病的发生发展过程。TL1A可同时刺激Th1和Th17途径,所以阻断TL1A的信号通路可能比单独阻断Th1类细胞因子如TNF-a,或者Th17类细胞因子如IL-17, IL-23更具疗效。此外,TL1A还可以激活成纤维细胞,这些细胞是纤维化的主要来源。因此,TL1A是一种调节粘膜免疫和纤维化的重要因子。目前TL1A抗体在IBD领域的开发已进入白热化阶段,最终3期临床的疗效如何,first-in-class和best-in-class药物分别花落谁家,将是未来几年的看点。
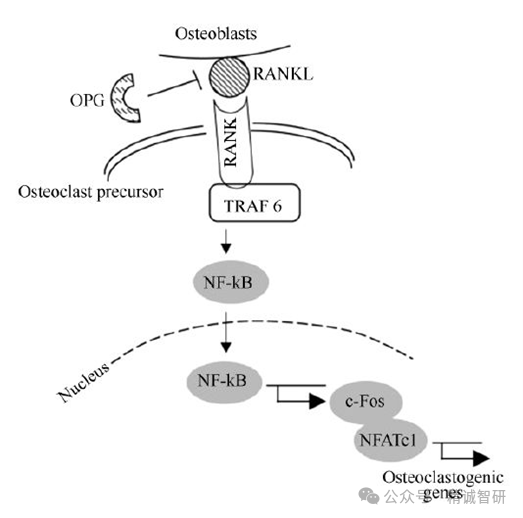
RANKL
20世纪90年代初,Amgen的科学家发现一种特别的TNFR家族成员OPG,表达OPG的转基因小鼠的骨密度有所增加。后续的试验证明OPG可以抑制破骨细胞的形成,从而导致骨密度的增加。OPG的这一作用机制对于我们更深入了解骨形成和骨调节的过程具有里程碑式的意义。再后来的研究证明,OPG是可溶性的诱饵受体,可与成骨细胞上的RANKL结合,从而阻断成骨细胞和破骨细胞前体之间的RANKL-RANK相互作用。
基于转基因小鼠平台和亲和力筛选,Amgen获得了具有高亲和力的全人源抗体AMG162(Denosumab)。2010年6月,Denosumab(商用名Prolia)获得FDA批准用于治疗女性更年期后的骨质疏松症,这是全世界首款也是迄今唯一一款用于骨质疏松的单克隆抗体。在同年11月, Denosumab 又收获预防实体瘤骨转移适应症,商品名Xgeva。之后,Denosumab又收获骨巨细胞瘤、恶性高钙血症、多发性骨髓瘤骨骼相关事件等适应症。2020年,Prolia 和 Xgeva的全年销售额总共超过50亿美元。
TNF超家族还有一些成员有相应的靶点开发计划,因为关注度不高,或者临床疗效一般,这里就一一介绍了。
